octubre 24, 2025
Pacientes con Piel de Mariposa reclaman la aprobación en España de una terapia validada en Europa hace medio año
A.S./J.M. Ya han pasado 180 días desde que Europa aprobó el uso de Vyjuvek, la primera terapia génica para la Piel de Mariposa, una enfermedad extremadamente dolorosa que convierte cada roce del cuerpo en una herida.
El tratamiento ayuda a cicatrizar incluso heridas crónicas, pero no está todavía disponible en España.
Sí se administra ya en hospitales de Francia, Italia o Alemania.
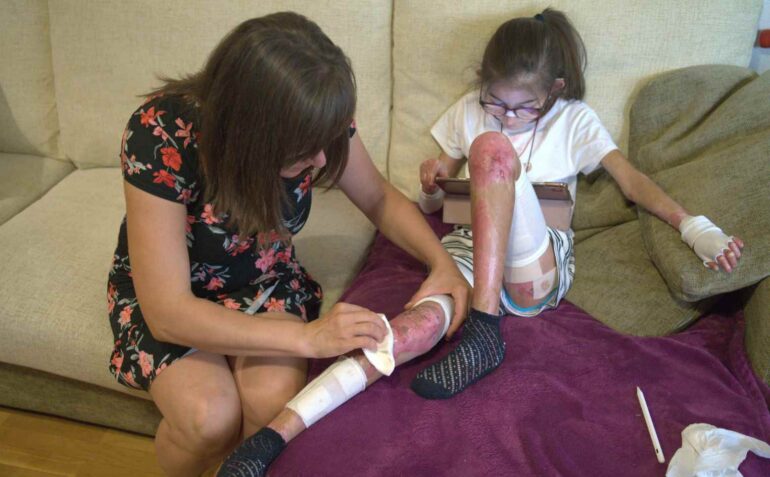
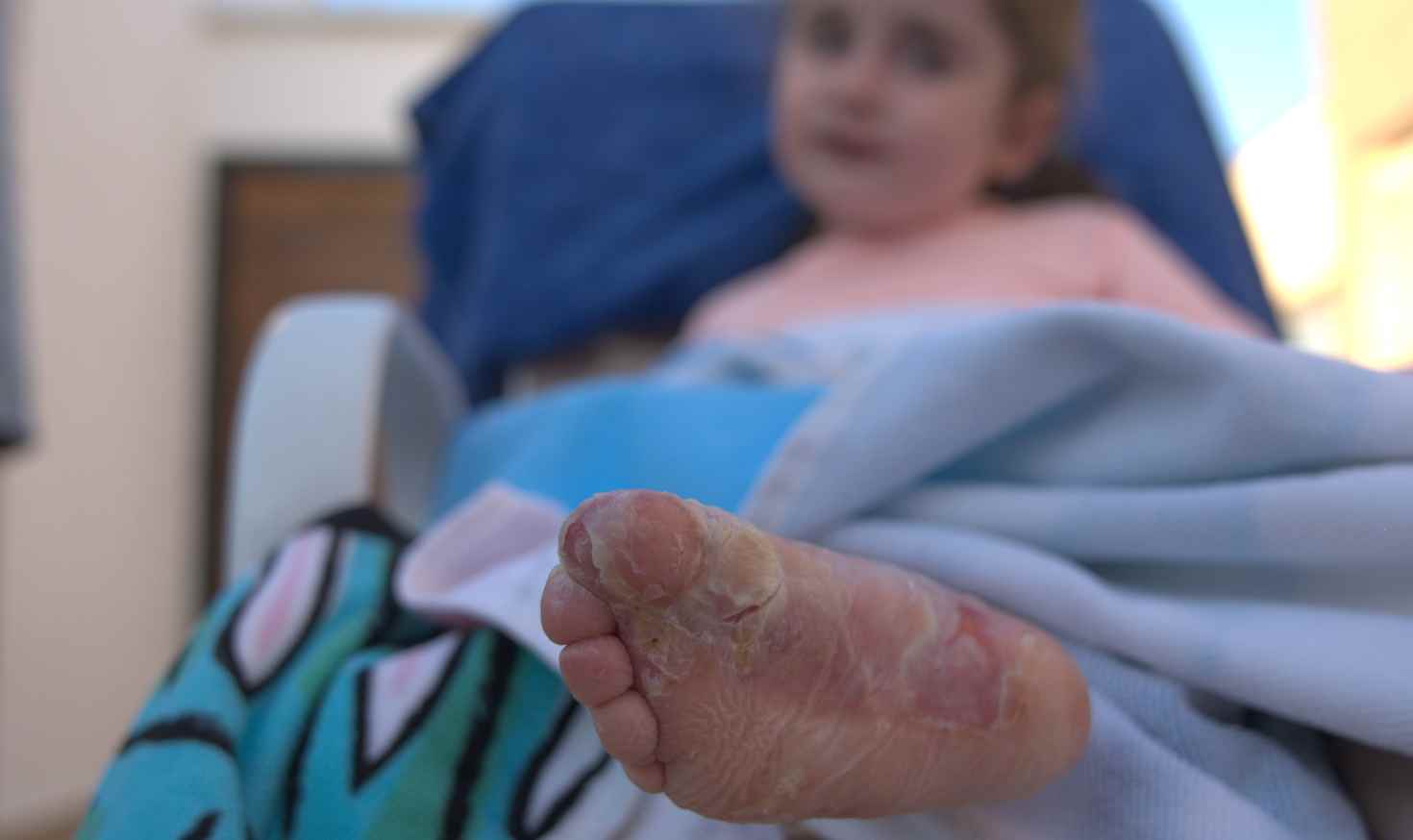
La Piel de Mariposa, o Epidermólisis Bullosa (EB) es una enfermedad genética, minoritaria e incurable que provoca una extrema fragilidad en la piel y en las mucosas.
En la provincia de Alicante hay 20 personas diagnosticadas y con tratamiento.
Este 25 de octubre se conmemora el Día Internacional de la Piel de Mariposa.
Las personas que viven con esta enfermedad carecen de las proteínas necesarias para mantener unidas las capas de la piel. Y, como resultado, su piel se vuelve tan frágil como las alas de una mariposa.
Un leve roce, una caricia o el simple contacto con la ropa pueden causar heridas o ampollas que afectan hasta el 80 por ciento del cuerpo.
Actividades cotidianas como caminar, vestirse o comer pueden volverse muy dolorosas. Para proteger las heridas y prevenir infecciones, se tienen que hacer curas diarias que pueden durar entre 2 y 5 horas.

La ONG DEBRA Piel de Mariposa ha puesto en marcha una campaña de recogida de firmas para exigir la financiación urgente del medicamento, aprobado ya en Europa, y su incorporación al Sistema Nacional de Salud.
Aseguran que, en los seis meses que lleva aprobado el tratamiento, ya se podrían hacer evitado más de cuatro millones de minutos de curas dolorosas.
La directora de DEBRA España, Evanina Morcillo, señala que “cada día de retraso son nuevas heridas, más dolor y más desolación. Las curas diarias duran horas y son devastadoras, física y emocionalmente. En otros países, Vyjuvek ya ha transformado vidas. En España, queremos que nuestras familias con Piel de Mariposa resten horas a su dolor. Confiamos en que las entidades responsables den acceso cuanto antes a la terapia génica”.
La legislación europea establece un plazo máximo de 180 días para que cada país evalúe e incorpore a su sistema los medicamentos aprobados por la Agencia Europea del Medicamento, pero en España la empresa farmacéutica aún no ha solicitado el código nacional del medicamento, un paso imprescindible para iniciar su comercialización y acceso en el país.
Desde DEBRA señalan que la compañía asegura que está trabajando en ello, pero seis meses después de la aprobación europea todavía no ha presentado una solicitud oficial para su inclusión en la cartera común de servicios del Sistema Nacional de Salud. El proceso, por tanto, ni siquiera ha comenzado, y ninguna familia española ha tenido aún acceso a Vyjuvek.
El medicamento también ha sido aprobado ya en otros países fuera de la Unión Europea, como por ejemplo, Estados Unidos (2023) y Japón (2025).
Pulsando aquí se puede firmar y colaborar con DEBRA.


 octubre 24, 2025
octubre 24, 2025






Comentarios de las entradas (0)